EARNEST
Entyvio er det første biologiske legemidlet som er indisert til behandling av voksne pasienter med moderat til alvorlig aktiv kronisk pouchitt.
EARNEST [1]
Entyvio (vedolizumab) er det første biologiske legemiddelet som er indisert til behandling av voksne pasienter med moderat til alvorlig aktiv kronisk pouchitt som har gjennomgått proktokolektomi og bekkenreservoarkirurgi for ulcerøs kolitt, og har hatt utilstrekkelig respons eller mistet respons på antibiotikabehandling.
Bakgrunn
EARNEST-studien er en randomisert, dobbeltblind, placebokontrollert studie for å evaluere effekt og sikkerhet av vedolizumab sammenlignet med placebo hos pasienter med kronisk pouchitt ved uke 14 og uke 34. Pasientene (n = 102) ble randomisert (1:1) til å motta enten intravenøs Entyvio 300 mg eller intravenøst placebo ved uke 0, 2 og 6 og deretter hver 8. uke til uke 30. Det primære endepunktet var klinisk remisjon definert som en mPDAI-skår (modified Pouchitis Disease Activity Index) på < 5 og en reduksjon i total mPDAI-skår på ≥2 poeng fra baseline ved uke 14.
Metode
Inkluderte pasienter hadde vært gjennom proktokolektomi og bekkenreservoarkirurgi for ulcerøs kolitt minst ett år før randomisering, og hadde utviklet aktiv kronisk pouchitt betegnet som antibiotikaavhengig (tilbakevendende) eller antibiotika-refraktær) med en baseline mPDAI-skår ≥ 5 og endoskopisk subskår på ≥ 2. Alle pasienter fikk antibiotikabehandling samtidig med ciprofloxacin 500 mg to ganger daglig fra starten av behandlingen og til og med uke 4. Pasienter fikk ytterligere runder med antibiotika under studien etter behov, inkludert i forbindelse med utbrudd av pouchitt.
Resultater
Signifikant flere pasienter behandlet med Entyvio oppnådde klinisk remisjon sammenlignet med placebo i uke 14 og 34. Ved uke 14 oppnådde 31,4 % av pasientene behandlet med Entyvio klinisk remisjon sammenlignet med 9,8 % i placebo-gruppen. I uke 34 oppnådde 35,3 % av pasientene behandlet med Entyvio klinisk remisjon, sammenlignet med 17,6 % i placebo-gruppen.
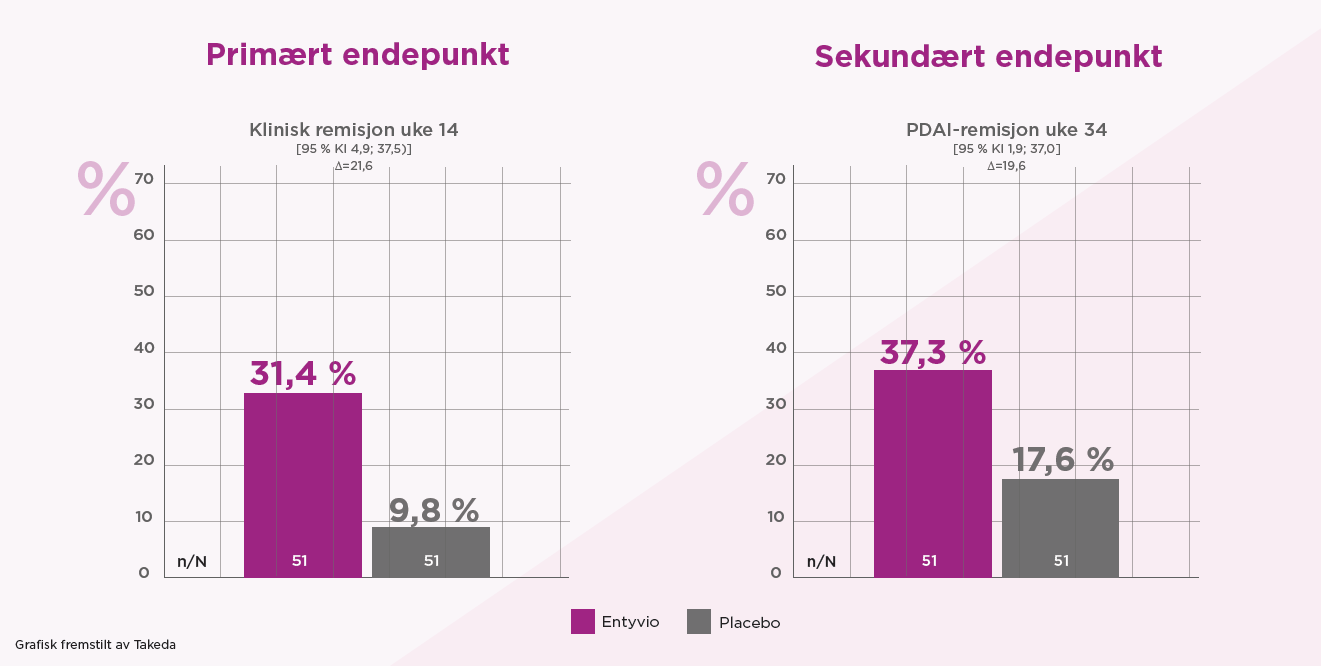
Klinisk remisjon er definert som en mPDAI-skår på <5 og en reduksjon i total mPDAI- skår på ≥2 poeng fra baseline. PDAI-remisjon er definert som PDAI-skår <7 og en reduksjon i PDAI-skår på ≥3 poeng fra baseline.
Sikkerhet
Overfølsomhetsreaksjoner, inkludert Infusjonsrelaterte bivirkninger (IRR), ble rapportert hos 3 av 51 pasienter (5,9 %) i Entyvio-gruppen og 2 av 51 pasienter (3,9 %) i placebo-gruppen. De mest vanlige rapporterte overfølsomhetsreaksjonene var munnsår, hevelse, perifert ødem, ubehag i brystet, asteni, akutt nyreskade, obstruktiv lungesykdom og rødming.
Alle bivirkningene som ble rapportert ble kategorisert som milde til moderate i intensitet. Ingen ble ansett som alvorlige, og ingen resulterte i avslutning av behandling.
Det var ingen signifikant økning i hyppigheten av alvorlige infeksjoner over tid.
Kun 1 av 51 pasienter (2,0 %) i Entyvio-gruppen opplevde en alvorlig gastroenterittinfeksjon. Pasienten kom seg etter hendelsen og fullførte studien.
Konklusjon
Signifikant flere pasienter behandlet med Entyvio oppnådde klinisk remisjon sammenlignet med placebo i uke 14 og 34. Entyvio er nå det første biologiske legemiddelet som er indisert til behandling av voksne pasienter med moderat til alvorlig aktiv kronisk pouchitt.
C-APROM/NO/ENTY/0779 januar 2023
Referanser
-
1.
- ^ Entyvio (vedolizumab) SPC (31.01.2022) avsnitt 3, 4.1, 4.3–4.6 og 4.8
entyvio.no
Denne siden inneholder informasjon kun for helsepersonell som lege, tannlege, offentlig godkjent sykepleier, farmasøyt, optiker, tannpleier, samt studenter i disse fag. Ved å klikke JA bekrefter du at du er helsepersonell.
JEG ER HELSEPERSONELL JEG ER IKKE HELSEPERSONELLVi gjør oppmerksom på at Takeda ikke er ansvarlig for innhold på eksterne nettsider.
FORLAT SIDEN BLI PÅ SIDEN