GEMINI I
GEMINI I evaluerte effekt og sikkerhet av Entyvio (vedolizumab) sammenlignet med placebo ved ulcerøs kolitt i 52 uker.
GEMINI I – REGISTRERINGSTUDIE ULCERØS KOLITT [1]
Studien evaluerte effekt og sikkerhet av Entyvio (vedolizumab) som induksjons- og vedlikeholdsbehandling ved ulcerøs kolitt sammenlignet med placebo, ved uke 52.
Induksjonsbehandling
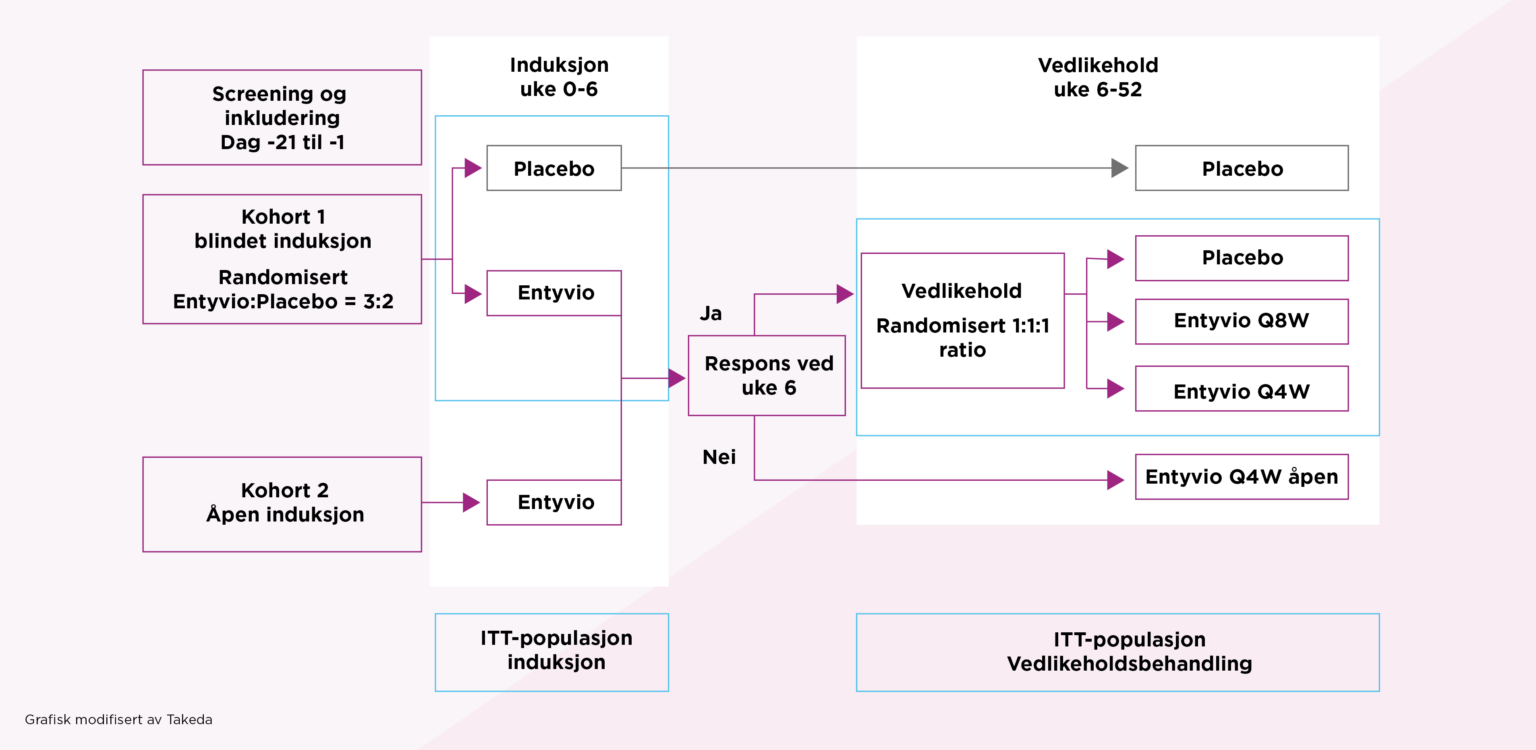
I GEMINI I ble pasienter randomiserte til å få blindet induksjonsbehandling med Entyvio eller placebo i uke 0 og 2. En gruppe fikk også åpen behandling med Entyvio.
Vedlikeholdsbehandling
Pasienter fra både åpen og blindet induksjonsbehandling med respons i uke 6, ble randomisert til blindet vedlikeholdsbehandling med Entyvio hver åttende eller hver fjerde uke, eller placebo. De som ikke oppnådde respons ved uke 6 fikk vedlikeholdsbehandling med Entyvio åpent hver fjerde uke. e.
Studiedesign GEMINI I
Pasienter med ulcerøs kolitt i GEMINI I [1]
I GEMINI I (n = 895) ble effekt og sikkerhet av Entyvio undersøkt ved behandling av pasienter med moderat til alvorlig aktiv ulcerøs kolitt.
Induksjonsbehandling GEMINI I
I GEMINI I ble 374 pasienter randomisert til å få blindet behandling med Entyvio (n = 225) eller placebo (n =149). I tillegg fikk 521 pasienter åpen behandling med Entyvio.
Vedlikeholdsbehandling GEMINI I
Pasienter med klinisk respons på Entyvio i uke 6 (n=373) ble videre randomisert til blindet vedlikeholdsbehandling med Entyvio hver 4. eller 8. uke, eller med placebo.
Pasienter sviktet på minst en behandling
Pasienter inkludert i GEMINI I var både anti-TNFα-naive og anti-TNFα -eksponerte. Pasienter i GEMINI I hadde hatt minst én sviktende konvensjonell behandling (som kortikosteroider og/eller immunmodulatorer) og/eller anti-TNFα for ulcerøs kolitt.
Dosering i studien og kombinasjon med andre legemidler [1]
Pasientene ble behandlet med 300 mg Entyvio® hver 8. eller 4. uke. Samtidig stabile doser av 5-ASA, orale kortikosteroider og immunmodulatorer var tillatt.
Effektdata uke 6 og 52 (GEMINI I)
Primære endepunkt
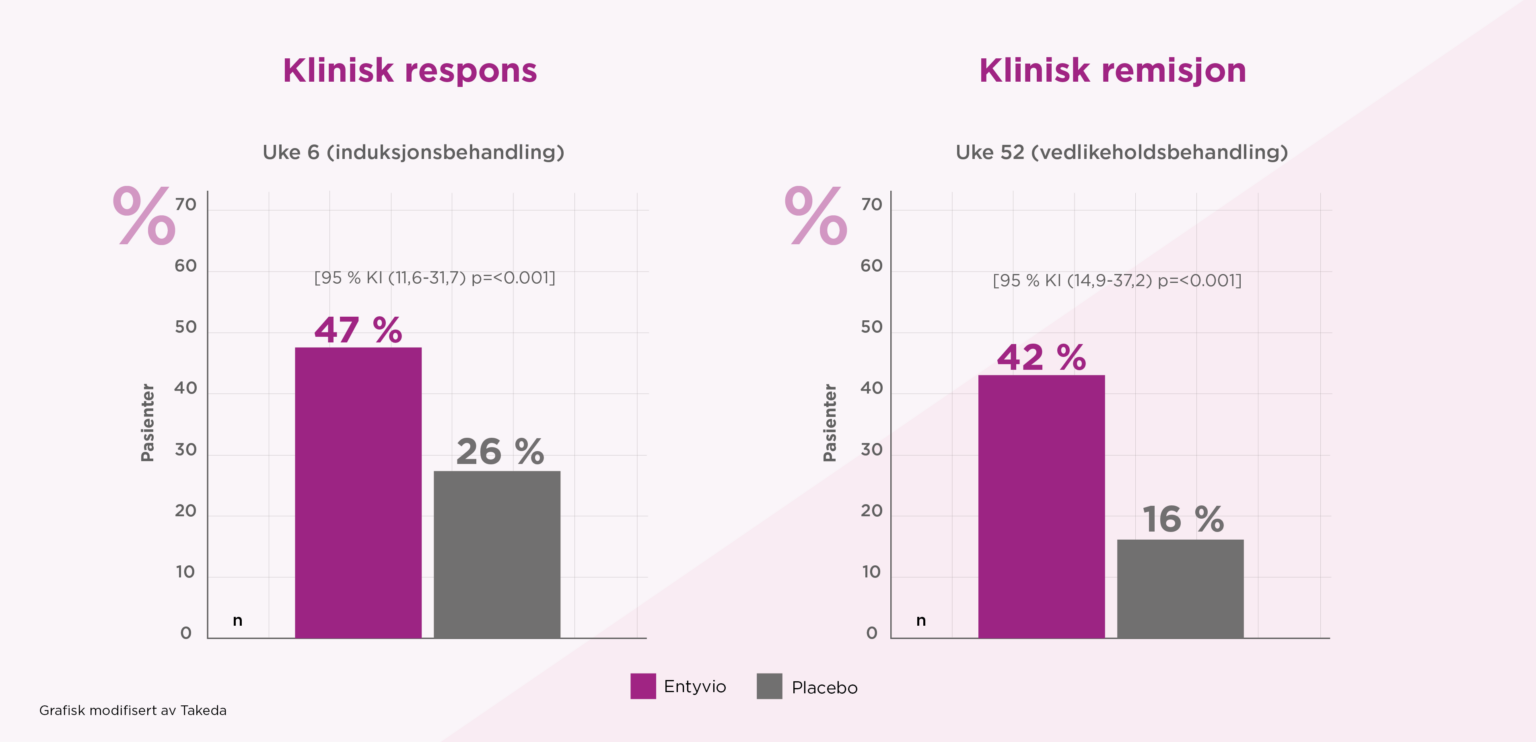
Det primære endepunktet for induksjon var klinisk respons ved uke 6, definert som reduksjon i Mayo-score på ≥3 poeng og en reduksjon på ≥30 % fra baseline score, med en reduksjon på ≥1 poeng på rektal blødning subscore eller en absolutt rektal blødning subscore på 0 eller 1. Det primære endepunktet for vedlikehold var klinisk remisjon i uke 52, definert som Mayo score ≤ 2, med ingen subscore > 1.
En signifikant høyere andel pasienter oppnådde klinisk respons i uke 6 og klinisk remisjon i uke 52 med Entyvio hver åttende uke sammenlignet med placebo.
Sekundære endepunkter
Slimhinnetilheling
Mer enn halvparten (52 %) av pasientene som fikk Entyvio® hver åttende uke oppnådde slimhinnetilheling i uke 52. Dette var signifikant høyere enn placebo (20 %), p<0,001. Slimhinnetilheling er definert som Mayo endoskopisk subscore på 0 eller 1.
Kortikosteroidfri remisjon i uke 52
Andelen pasienter som fikk kortikosteroider ved baseline og som oppnådde kortikosteroidfri remisjon var signifikant høyere for pasienter behandlet med Entyvio (31 %) sammenlignet med placebo (14 %), p=0,01. Kortikosteroidfri remisjon er definert som: Pasienter som brukte perorale kortikosteroider ved utgangspunktet (baseline) og som startet kortikosteroidnedtrapping i uke 6 og var i klinisk remisjon uten kortikosteroider i uke 52.
Sikkerhet
Bivirkninger
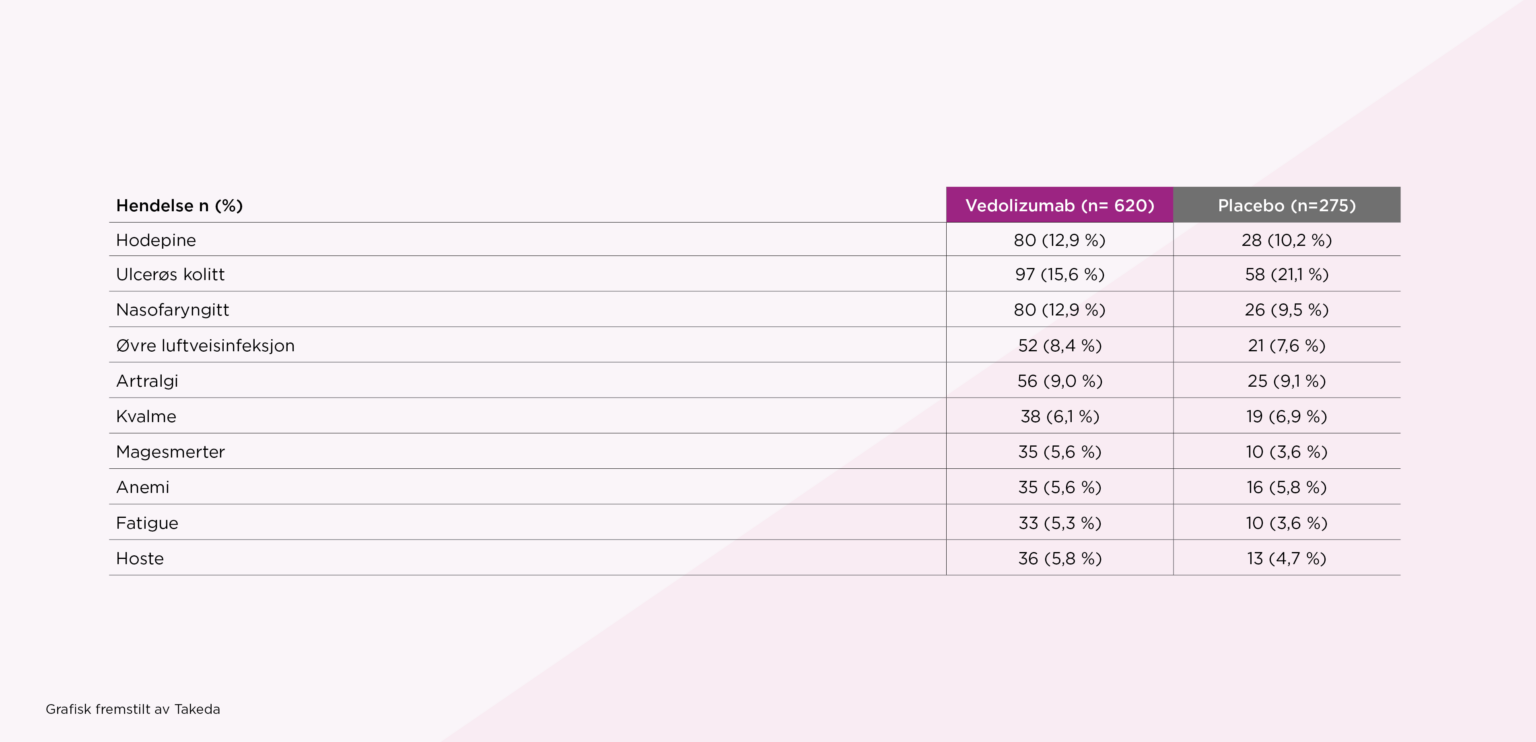
Ingen signifikante forskjeller ble observert mellom studiegruppene når det gjelder de hyppigst rapporterte bivirkninger.
De hyppigst rapporterte bivirkningene er listet opp i tabellen under:
Infeksjoner [2]
I de kontrollerte studiene GEMINI 1 og 2 (henholdsvis ulcerøs kolitt og Crohns sykdom) med intravenøs Entyvio var hyppigheten av infeksjoner 0,85 per pasientår i gruppen som fikk Entyvio, og 0,70 per pasientår i gruppen som fikk placebo.
Infeksjonene besto primært av nasofaryngitt, øvre luftveisinfeksjoner, sinusitt og urinveisinfeksjoner. De fleste pasientene fortsatte med Entyvio når infeksjonen var over.
I de kontrollerte studiene GEMINI 1 og 2 med intravenøs vedolizumab var hyppigheten av alvorlige infeksjoner 0,07 per pasientår i gruppen som fikk vedolizumab og 0,06 per pasientår i gruppen som fikk placebo. Det var ingen signifikant økning i hyppigheten av alvorlige infeksjoner over tid.
Ingen tilfeller av PML ble observert.
Infusjonsrelaterte reaksjoner (IRR)
I de kontrollerte studiene GEMINI 1 og 2 (ulcerøs kolitt og Crohns sykdom) opplevde 4 % av pasientene som fikk intravenøs Entyvio og 3 % av pasientene som fikk placebo en uønsket reaksjon definert av utprøver som en infusjonsrelatert reaksjon (IRR).
Majoriteten av IRR var milde eller moderate i intensitet og ˂ 1 % resulterte i avbrytelse av studiebehandling. Observerte IRR forsvant vanligvis uten, eller med minimal intervensjon, etter infusjonen. De fleste infusjonsrelaterte reaksjonene oppstod innen de to første timene.
Malignitet
Resultater fra det kliniske programmet antyder ikke økt risiko for malignitet ved behandling med Entyvio frem til nå.
C-APROM/NO/ENTY/0777 september 2025
Referanser
entyvio.no
Denne siden inneholder informasjon kun for helsepersonell som lege, tannlege, offentlig godkjent sykepleier, farmasøyt, optiker, tannpleier, samt studenter i disse fag. Ved å klikke JA bekrefter du at du er helsepersonell.
JEG ER HELSEPERSONELL JEG ER IKKE HELSEPERSONELLVi gjør oppmerksom på at Takeda ikke er ansvarlig for innhold på eksterne nettsider.
FORLAT SIDEN BLI PÅ SIDEN